Артикул: 1043901
Раздел:Технические дисциплины (57837 шт.) >Химия (5274 шт.) >
Физическая химия (643 шт.)
Название или условие:
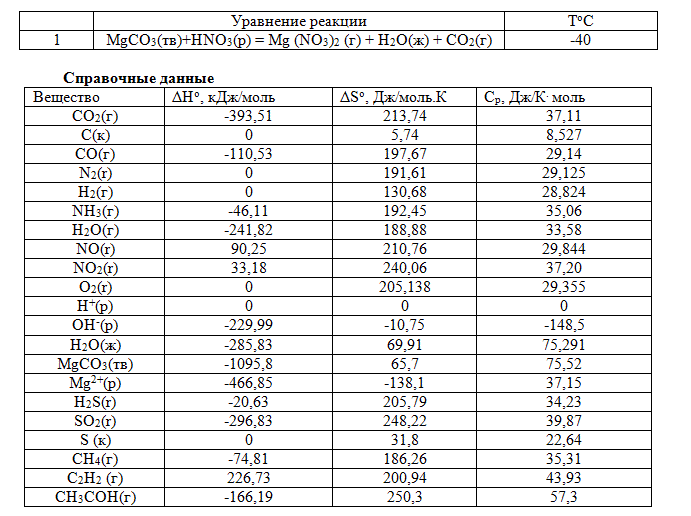
Запишите в тетрадь уравнение реакции вашего варианта (см. табл.) и используя справочные данные:
1. рассчитайте изменение стандартной энтальпии химической реакции. Сделайте вывод о тепловом эффекте химической реакции;
2. рассчитайте изменение энтальпии химической реакции при температуре Т°С, если Ср веществ не зависит от температуры;
3. рассчитайте изменение внутренней энергии реакции при стандартных условиях и при температуре Т°С;
4. рассчитайте изменение энтропии реакции при стандартных условиях и при температуре Т°С;
5.рассчитайте изменение энергии Гиббса при стандартных условиях и при температуре Т°С. Сделайте вывод о самопроизвольности протекания реакции при р,Т = const. Какой из факторов процесса, энтальпийный или энтропийный, способствует самопроизвольному протеканию процесса в прямом направлении;
6.рассчитайте изменение энергии Гельмгольца при стандартных условиях и при температуре Т°С. Сделайте вывод о самопроизвольности протекания реакции при V,Т = const;
7. рассчитайте температуру при которой система будет находится в равновесии при р,Т = сonst, соответствующих стандартным условиям?
8. рассчитайте работу расширения, которая совершается при протекании реакции при стандартных условиях.
Описание:
Подробное решение в WORD
Изображение предварительного просмотра:
Процесс покупки очень прост и состоит всего из пары действий:
1. После нажатия кнопки «Купить» вы перейдете на сайт платежной системы, где можете выбрать наиболее удобный для вас способ оплаты (банковские карты, электронные деньги, с баланса мобильного телефона, через банкоматы, терминалы, в салонах сотовой связи и множество других способов)
2. После успешной оплаты нажмите ссылку «Вернуться в магазин» и вы снова окажетесь на странице описания задачи, где вместо зеленой кнопки «Купить» будет синяя кнопка «Скачать»
3. Если вы оплатили, но по каким-то причинам не смогли скачать заказ (например, случайно закрылось окно), то просто сообщите нам на почту или в чате артикул задачи, способ и время оплаты и мы отправим вам файл. Условия доставки: Получение файла осуществляется самостоятельно по ссылке, которая генерируется после оплаты. В случае технических сбоев или ошибок можно обратиться к администраторам в чате или на электронную почту и файл будет вам отправлен. Условия отказа от заказа: Отказаться возможно в случае несоответсвия полученного файла его описанию на странице заказа. Возврат денежных средств осуществляется администраторами сайта по заявке в чате или на электронной почте в течении суток.
