Артикул: 1031682
Раздел:Технические дисциплины (57837 шт.) >Химия (5274 шт.) >
Физическая химия (643 шт.)
Название или условие:
Определите состав реакционной смеси до и после реакции. Составьте таблицу материального баланса
Дано:
1 Химическая реакция для расчета материального баланса CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 (рис.1)
2. Характеристики исходных растворов: (рис.2)
Сн (CuSO4) = 2 моль-экв/л; mр-ра (CuSO4) = 1,2 кг; ρ(CuSO4) = 1,31 г/мл;
СМ (NaOH) = 2,5 моль/л; mр-ра (NaOH) = 1,2 кг; ρ(NaOH) = 1,11 г/мл; η = 0,85
Рассчитайте ΔH0298 , ΔS0298, ΔG0298 химической реакции. Возможно ли осуществить реакцию при 473 К?
Рассчитайте энергию Гиббса, энтальпию, энтропию данного процесса при температуре 298 К.
Возможна ли данная реакция при температуре 473 К?
Из справочника берём исходные данные: (рис 3)
1) Определяем энтальпию данной реакции при Т=298 К:
2) Определяем энтропию данной реакции при Т=298 К:
3) Определяем энергию Гиббса при Т = 298 К: И при Т = 473 К:
Описание:
Подробное решение в WORD
Изображение предварительного просмотра:
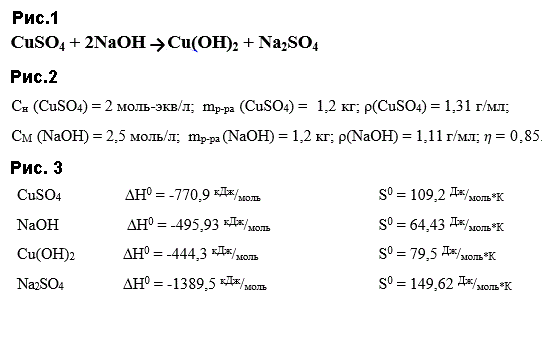
Процесс покупки очень прост и состоит всего из пары действий:
1. После нажатия кнопки «Купить» вы перейдете на сайт платежной системы, где можете выбрать наиболее удобный для вас способ оплаты (банковские карты, электронные деньги, с баланса мобильного телефона, через банкоматы, терминалы, в салонах сотовой связи и множество других способов)
2. После успешной оплаты нажмите ссылку «Вернуться в магазин» и вы снова окажетесь на странице описания задачи, где вместо зеленой кнопки «Купить» будет синяя кнопка «Скачать»
3. Если вы оплатили, но по каким-то причинам не смогли скачать заказ (например, случайно закрылось окно), то просто сообщите нам на почту или в чате артикул задачи, способ и время оплаты и мы отправим вам файл. Условия доставки: Получение файла осуществляется самостоятельно по ссылке, которая генерируется после оплаты. В случае технических сбоев или ошибок можно обратиться к администраторам в чате или на электронную почту и файл будет вам отправлен. Условия отказа от заказа: Отказаться возможно в случае несоответсвия полученного файла его описанию на странице заказа. Возврат денежных средств осуществляется администраторами сайта по заявке в чате или на электронной почте в течении суток.
